Kamikaze-Erreger als Speerspitze der bakteriellen Infektion
Wie einige wenige Soldatenzellen sich selbst opfern, um einer ganzen Bakterienpopulation krankmachende Eigenschaften zu verleihen
Plötzlich fühlt man sich krank. Pathogene Bakterien haben es geschafft, sich im Körper anzusiedeln und auszubreiten! Die Waffen, die sie für ihre Invasion einsetzen, sind schädliche Toxine. Damit zielen sie auf Abwehrmechanismen und lebenswichtige Zellfunktionen des Wirts. Bevor diese tödlichen Gifte die Wirtszellen angreifen können, müssen die Bakterien sie zunächst über spezielle Sekretionssysteme freisetzen. Die Gruppe um Stefan Raunser, Direktor am Max-Planck-Institut für molekulare Physiologie in Dortmund, hat nun einen bislang rätselhaften und außergewöhnlichen Sekretionsmechanismus aufgeklärt. In einer Art Kamikaze-Angriff setzt eine kleine Gruppe sogenannter „Soldaten“-Bakterien, die bis zum Rand mit Toxinen gefüllt sind, ihre tödliche Fracht frei, indem sie im Wirt explodieren. Eine gezielte Bekämpfung dieser Subpopulationen könnte eine vielversprechende Strategie zur Behandlung von Krankheiten sein, die durch Bakterien mit zunehmender Antibiotikaresistenz ausgelöst werden.
Jahrzehntelang war es rätselhaft
Sobald ein pathogenes Bakterium in seinen Wirt eingedrungen ist, setzt es eine Reihe von Abwehr- und Angriffsmechanismen in Gang. Dazu gehört die Sekretion einer Reihe von toxischen Proteinen. Diese können die zelluläre Abwehr des Wirts untergraben. So kann sich das Bakterium ausbreiten, in tiefere Gewebe und Organe eindringen und diese besiedeln. Bei gramnegativen Bakterien, die schwere Infektionen auslösen können und zunehmend Resistenzen gegen Antibiotika entwickeln, müssen die toxischen Proteine mehrere zelluläre Barrieren überwinden, um schließlich ihr Ziel zu erreichen. Zu diesem Zweck haben die Bakterien eine Reihe von spezialisierten Sekretionssystemen entwickelt. Während einige davon eine Vielzahl von Toxinen sekretieren können und in fast allen Bakterien zu finden sind, sind andere Systeme nur in wenigen Bakterien identifiziert worden. Der Mechanismus für die Sekretion vieler kleinerer Toxine ist bereits bekannt. Nicht so bei größeren, wie den Tc-Toxinen, die von den berüchtigten Yersinia-Bakterien produziert werden, zu denen auch die Erreger von Pest und Tuberkulose gehören. „Jahrzehntelang war es rätselhaft, wie die riesigen Tc-Toxine an ihren Bestimmungsort gelangen. In unseren früheren Arbeiten haben wir mittels Kryo-Elektronenmikroskopie die erste 3D-Struktur eines Tc-Toxins aufgeklärt. So konnten wir bereits herausfinden, wie das Toxin die letzte Barriere, die Wirtsmembran, mit Hilfe eines spritzenartigen Injektionsmechanismus durchbricht. Jetzt konnten wir das Bild vervollständigen und zeigen, wie diese Toxine die drei Barrieren, die das Innere des Bakteriums von seiner Umgebung trennen, auf wirklich spektakuläre Weise überwinden“, sagt Stefan Raunser.
Explodierende Bakterien
In ihrer jüngsten Arbeit haben Raunser und sein Team mehrere hochmoderne Techniken kombiniert, um die Sekretion des Tc-Toxins YenTc zu untersuchen. Dieses wird von dem Insektenerreger Yersinia entomophaga produziert und spielt bei der Manifestation der Infektion eine maßgebliche Rolle. Die größte Herausforderung bestand für die Forschenden zunächst darin, herauszufinden, welche der bekannten Sekretionsmechanismen das Bakterium nutzt. Zu diesem Zweck schalteten die Forschenden alle in Frage kommenden Sekretionssysteme nacheinander durch gezielte Genom-Editierung aus. Als keiner der Knockouts die Freisetzung des Toxins stoppte, wurde das Toxin mit der gleichen Technik so verändert, dass seine Sekretion sichtbar gemacht werden konnte. Diesmal mit Erfolg. „Zu sehen, wie einige der Bakterien buchstäblich explodieren und so ihre Toxine freisetzen, war ein echter Heureka-Moment“, sagt Oleg Sitsel, Erstautor der Studie. Mit sorgfältigen Proteomanalysen konnte schließlich ein erst vor kurzem entdecktes pH-sensitives Typ-10-Sekretionssystem identifiziert werden, das für die Freisetzung des Toxins verantwortlich ist. Mittels Kryo-Elektronentomographie konnte anschließend en detail sichtbar gemacht werden, wie dieses Sekretionssystem Schritt für Schritt zelluläre Inhalte über einen bisher unbekannten lytischen Wirkmechanismus exportiert – und so die drei Barrieren überwindet, die gramnegative Bakterien umgeben.
Die Verwandlung in eine Soldaten-Bakterie
Die Forschenden fanden heraus, dass nur eine kleine spezialisierte Untergruppe von Bakterienzellen die Toxine freisetzt und das mit dem Tod bezahlt. Doch was veranlasst diese Zellen, die von den Autoren als „Soldatenzellen“ bezeichnet werden, sich zunächst zu vergrößern und einen tödlichen Toxin-Cocktail mit YenTc zu produzieren, um dann zum Wohle ihrer Kameraden Selbstmord zu begehen? Die Forschenden stellten zunächst fest, dass das Auftreten von Soldatenzellen temperatur-, nährstoff- und zelldichteabhängig ist. Dann entdeckten sie einen temperaturabhängigen genetischen Schalter, der die Produktion der Toxine mit der Produktion des Sekretionssystems synchronisiert und „normale“ Zellen in Soldaten verwandelt. Die Massenproduktion von Toxinen und die Vergrößerung der Zellen sorgen dafür, dass nur wenige Individuen für das Wohl der Bakterienpopulation geopfert werden müssen – eine äußerst effiziente Strategie.
„Wir vermuten, dass sich normale Zellen bei der Nahrungsaufnahme als Reaktion auf die Nährstoffe des Insektenwirts in Soldatenzellen verwandeln. Die Toxinsekretion ist pH-empfindlich, was die Freisetzung verzögert, bis die Soldatenzellen den alkalischen hinteren Mitteldarm erreichen, ihren Einsatzort“, erklärt Raunser.
Strategie im Kampf gegen pathogene Bakterien
„Diese Sekretionsstrategie ist einzigartig und bemerkenswert. Das Verhalten dieser Bakterien weist Merkmale wie Differenzierung und Altruismus auf, die an eusoziale Systeme erinnern. Sollte sich dies als ein gewöhnlicher Mechanismus herausstellen, haben wir möglicherweise eine Schwachstelle der Bakterien aufgedeckt: Die gezielte Bekämpfung der Soldatenzellen könnte eine vielversprechende medizinische Strategie im Kampf gegen pathogene Bakterien werden, insbesondere in Zeiten zunehmender Resistenzen gegen Antibiotika“, schließt Raunser ab.
Quelle: Max-Planck-Institut für molekulare Physiologie

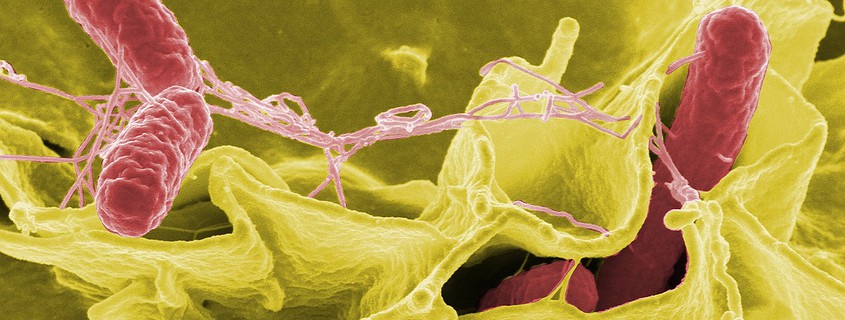 Bild von
Bild von 

 Pixabay
Pixabay

 Foto von cottonbro studio: https://www.pexels.com/de-de/foto/person-suche-festhalten-verletzung-5722161/
Foto von cottonbro studio: https://www.pexels.com/de-de/foto/person-suche-festhalten-verletzung-5722161/